elastin är ett strukturellt protein som är involverat i att bygga upp bindväv i lungor, blodkärl och hud. Till skillnad från kollagen, som också finns i bindväv, är det mycket elastiskt. Elastinmolekylerna nätverkar med varandra i det extracellulära området.
Vad är elastin?
Alla ryggradsdjur innehåller fiberproteinet elastin. Det är ett strukturellt protein som ansvarar för utformningen av så viktiga organ som lungorna, blodkärlen eller huden. Tillsammans med kollagen bildar den bindvävnaden i dessa organ.
Egenskaperna hos elastin och kollagen kompletterar varandra. Elastin är, som namnet antyder, mycket elastiskt i motsats till kollagen. Detta gör bindvävnaden i hud, lungor och blodkärl elastisk och formbar. Funktionerna för dessa tre organ kräver konstant storlek. Elastin består huvudsakligen av aminosyrorna alanin, glycin, prolin, valin, lysin, leucin och isoleucin. Hydrofoba och hydrofila områden växlar i molekylen.
Karakteristiska enheter för de fyra aminosyrorna alanin, prolin, glycin och valin upprepas inom varje hydrofob domän. De hydrofila områdena har huvudsakligen lysin. Lysinresten oxideras till allysin av enzymet lysyloxidas. Den terminala aminogruppen ersätts av en karboxylgrupp. Lysinresterna i de olika proteinkedjorna kombineras med varandra för att bilda ett ringformat desmosin och därmed tvärbinda de olika kedjorna med varandra.
Funktion, effekt och uppgifter
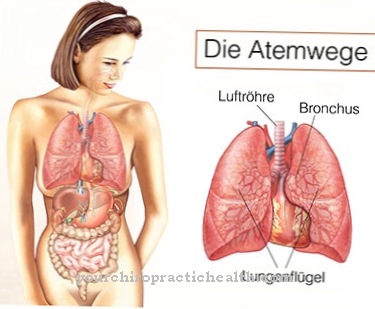
Som ett strukturellt protein i bindvävnaden har elastin uppgiften att säkerställa formen och elasticiteten i lungorna, blodkärlen och huden. Alla tre organ är beroende av bindvävs flexibilitet. De utsätts för ständiga volymförändringar.
Som strukturellt protein har bindvävnaden mestadels kollagen. Det är tåligt, men skulle vara för styvt som ett enda konstruktionselement. Endast kombinationen av egenskaperna hos elastin och kollagen gör att bindvävnaden blir elastisk och samtidigt rivbeständig. Den grundläggande byggstenen för elastin är tropoelastin. Tropoelastin består av alternerande hydrofoba och hydrofila domäner. Den har en ungefärlig molekylmassa på 72 kilodalton. Tropoelastinenheterna nätverkar med varandra vid lysinresterna.
Medan tropoelastin är vattenlösligt på grund av dess många hydrofila domäner, negeras den tvärbundna polymerens vattenlöslighet. Tropoelastin bildas i cellerna och når det extracellulära området via membrantransport. Det är här nätverkandet av de grundläggande byggstenarna sker, där ringformade desmosineenheter bildas vid nätverkspunkterna. Tre allysinrester och en lysinrest deltar alltid i bildningen av desmosin. Eftersom allysin är en oxidationsprodukt av lysin, är fyra lysinrester slutligen kopplade till varandra.
Denna form av anslutning ger elastinen dess speciella elasticitet. Tvärbindningen skyddar också elastin från denaturering och nedbrytning med nästan alla proteaser. Enzymet elastas är dock ett undantag, det är det enda proteaset som kan bryta ner elastin. På detta sätt bryts de elastiner som intas genom mat ned.
Utbildning, förekomst, egenskaper och optimala värden
Som redan nämnts är elastin en nödvändig komponent i lungvävnadens, blodkärlens och hudens bindväv. Detta påverkar alla ryggradsdjur. Den grundläggande byggstenen tropoelastin kan knappast detekteras i djurvävnad. Efter omvandlingen av lysinrester till allysin med lysyloxidas, är tre allysinrester omedelbart tvärbundna med en lysinrest. Elastin förekommer nästan uteslutande i sin nätverksform.
Icke desto mindre var detekteringen av tropoelastin i djurförsök genom att hämma syntesen av lysyloxidas framgångsrikt. Om detta enzym saknas finns det ingen omvandling av lysin till allysin och därmed inte heller någon elastinbildning. På grund av elastins motståndskraft mot nedbrytning av proteaser skyddas hud, lungor och blodkärl idealt. Den degraderande effekten av elastas begränsas av elastashämmare.
Sjukdomar och störningar
Mutationer i ELN-genen kan orsaka ärftliga sjukdomar där elastins struktur förändras. I så kallad dermatokalas finns det förändringar i bindväv, som manifesterar sig i inelastisk, sagging hud som sjunker i veck.
Sjukdomen kan både förvärvas och ärftlig. Familjekluster observeras. Förutom många andra symtom förekommer denna bindvävssvaghet också i Williams-Beuren syndrom. Detta är också en ärftlig strukturell avvikelse av elastin. Orsaken till denna sjukdom är en mutation på kromosom 7. Dessutom finns det en medfödd aortastenos, som är baserad på en störning i strukturen hos elastin. Hjärtans artär är smalare. Blodflödet från vänster kammare in i blodomloppet försenas.
Hjärtsvikt uppstår på lång sikt. Fem till sex procent av alla medfödda hjärtfel är medfödda aortastenos. Vissa former av Ehlers-Danlos-syndrom antas också vara elastin-missbildningar. Denna sjukdom kännetecknas av en översträckbar hud, som kallas gummihud. Bindvävnadens svaghet påverkar många organ, inklusive hjärtat och matsmältningskanalen. Syndromet ärftas vanligtvis som ett autosomalt dominerande drag.
I det så kallade Menkes syndrom finns det, utöver många andra symtom, också en svaghet i bindvävnaden, vars orsak finns i nedsatt elastinsyntes. Egentligen kännetecknas Menkes syndrom av en störning i absorptionen av koppar i kroppen. Emellertid är koppar en kofaktor för många enzymer. Detta inkluderar bland annat lysyloxidas. Utan koppar är enzymet ineffektivt. Omvandlingen av lysinresterna till allysin sker inte längre. Som ett resultat kan tvärbindningen av lysinresterna till desmosin inte längre fungera.


.jpg)