trypsin Som ett enzym i bukspottkörteln är det ansvaret för den ytterligare nedbrytningen av livsmedelsproteiner. Det fungerar i det starkt alkaliska området. Trypsinbrist leder till proteinbrist i kroppen på grund av den försämrade proteinsmältningen.
Vad är trypsin?
Trypsin är ett proteas som fortsätter nedbrytningen av proteiner i det alkaliska området i tunntarmen. I magen börjar proteinnedbrytning i den sura miljön av enzymet pepsin. Enzymet trypsin består av tre komponenter.
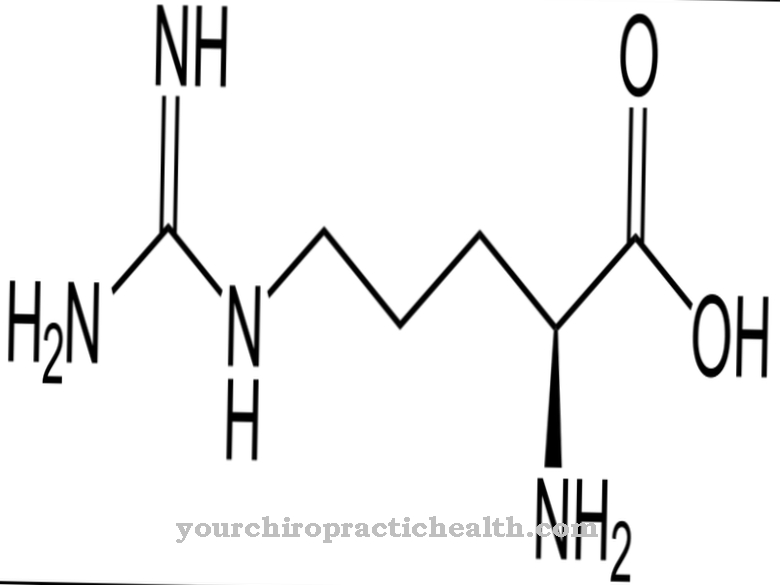
Dessa är trypsin-1 som katjon, trypsin-2 som anjon och trypsin-4. Två tredjedelar av enzymet består av trypsin-1 och en tredjedel av trypsin-2. Trypsin-4 eller mesotrypsin finns endast i små mängder. Trypsin är ett endoproteas. Det delar bara ett protein på vissa platser. Det är också ett serinproteas. Dess aktiva centrum innehåller den katalytiska triaden av asparaginsyra, histidin och serin. Den delar upp dietproteinerna företrädesvis vid de basiska aminosyrorna lysin, arginin och modifierad cystein.
Trypsin produceras från zymogenprekursorn trypsinogen med hjälp av den katalytiska verkan av tarmenszymet enteropeptidas. Enzymet består av 224 aminosyror. Trypsin utvecklar sin optimala effekt vid ett pH-värde av 7 till 8.
Funktion, effekt och uppgifter
Trypsins uppgift är att fortsätta nedbrytningen av proteiner som redan har börjat i magen i det alkaliska området. I magen börjar förfördelningen av matproteiner med det liknande enzymet pepsin i det sura intervallet.
Även här bryts proteinkedjorna vid vissa punkter. Medan denna uppdelning av proteinerna äger rum i magen på aromatiska aminosyror såsom fenylalanin, delas proteinerna och polypeptiderna med trypsin på de basiska aminosyrorna lysin och arginin såväl som på den modifierade cystein. En annan skillnad för pepsin är att trypsin utvecklar sin optimala effekt i det alkaliska området vid ett pH-värde av 7 till 8. Aktiverat trypsin omvandlar också andra zymogener såsom chymotrypsinogen, pro-elastas, prokarboxypeptidas och andra inaktiva enzymer till aktiva enzymer.
Konverteringen börjar omedelbart efter frisläppandet av trypsin. De andra proteaserna i bukspottkörteln är kymotrypsin, karboxipeptidas eller elastin. Dessutom aktiverar trypsin sig själv genom att konvertera trypsinogen. Enzymerna i bukspottkörteln är inledningsvis i sin inaktiva form för att inte bryta ner bukspottkörteln genom självsmältning. Först när de inaktiva förformerna utsöndras kan de aktiveras genom delning. Först katalyseras omvandlingen av trypsinogen till trypsin av enteropeptidas. Det är den enda funktionen av enteropeptidas.
En hexamer med den terminala aminosyran lysin delas av från trypsinogen. Eftersom trypsin också delar upp polypeptidkedjor på det basiska lysinet, katalyserar det nu också sin egen aktivering och samtidigt aktiveringen av de andra zymogenerna. Tillsammans med enzymerna chymotrypsin och elastas delar den upp större proteiner i tunntarmen och peptonerna (polypeptidkedjor) som produceras genom verkan av pepsin i tri- och dipeptider. Dessa mindre peptider bryts sedan ned ytterligare i aminosyror med hjälp av andra enzymer. I synnerhet bidrar trypsin också till nedbrytningen av aminosyran metionin. Lysin stimulerar bland annat bildningen av trypsin.
Utbildning, förekomst, egenskaper och optimala värden
Trypsin är ett endogent enzym som används för att smälta matproteiner. Det är därför det alltid utsöndras av bukspottkörteln strax efter att ha ätit. Emellertid kan enzymet också erhållas från animaliska källor och användas medicinskt. Den proteinsplittande effekten kan bland annat användas för att bryta ner kroppens egna proteinkomplex. Detta är hur immunkomplex kan lösas vid autoimmuna sjukdomar.
Inflammation i muskuloskeletalsystemet kan också behandlas väl med trypsin. Den aktiverar också enzymet plasmin från plasminogen. Plasmin löser upp fibrin när det finns en stark trombbildning. Med hjälp av trypsin kan trombos behandlas eller till och med förebyggas. Trypsin stöder dessutom matsmältningen när den tas under måltiderna. När den appliceras 1 till 2 timmar före eller efter en måltid, utvecklar den sina antiinflammatoriska effekter.
Sjukdomar och störningar
I samband med bristande brist på bukspottkörteln kan syntesen av matsmältningsenzymer såsom trypsin begränsas. Konsekvensen är utvecklingen av matsmältningsbesvär. Förutom proteaser producerar bukspottkörteln även lipaser och amylaser.
Om enzymerna saknas smälts inte matkomponenterna längre och hamnar i kolon. Om det till exempel saknas trypsin kan proteinet i kosten inte längre smälta ordentligt. Putrefaktiva bakterier sätter sig i tjocktarmen och bryter ned proteinerna anaerobt. Det finns enorma matsmältningsproblem med flatulens, diarré och buksmärta. Vidare leder den reducerade bildningen av aminosyror till en proteinbrist och undernäring trots tillräckligt med livsmedel. Emellertid kan enzymerna också tillföras från utsidan.
Men det finns också medicinska nödsituationer där kroppens egna enzymer som trypsin smälter själva bukspottkörteln. Detta kan hända om gallvägarna och bukspottkörtelna är blockerade. Trypsin frigörs men kan inte komma in i tunntarmen genom bukspottkörteln. Om bukspottkörteln inte öppnas i denna akuta nödsituation kommer resultatet att vara dödligt på grund av självupplösningen av bukspottkörteln. Även med tumörer i bukspottkörteln kan bukspottkörtelkanalen vara helt eller delvis stängd. Handlingen av matsmältningssaft i bukspottkörteln manifesterar sig som kronisk eller akut pankreatit.
Brist på trypsin kan också orsakas av en mutation. Det finns också ärftliga former av pankreatit när nedbrytningen av trypsin störs.



.jpg)