Ungefär hälften av alla proteiner finns i människokroppen glykoproteiner. Ämnen spelar en roll såväl som cellkomponenter som immunämnen. De bildas huvudsakligen som en del av den så kallade N-glykosyleringen och kan orsaka allvarliga sjukdomar om de inte monteras korrekt.
Vad är glykoproteiner?
Glykoproteiner är proteiner med trädliknande grenade heteroglykanrester. De har vanligtvis en viskös konsistens. Makromolekylerna innehåller kovalent bundna sockergrupper.
De består av monosackarider såsom glukos, fruktos, mannos eller acetylerat aminosocker. Det är därför de också kallas proteinbundna oligosackarider. Den kovalenta bindningen kan ske på olika sätt och motsvarar antingen en bindning till aminosyrorna serin eller asparagin. Bindningen till serin kallas O- och den till asparagin N-glykosylering. Glykoproteinerna som är involverade i N-glykosylering varierar i storlek. De motsvarar monosackarider, di- eller oligosackarider och till och med polysackarider.
Enligt deras andel monosackarider är de indelade i högmanos, komplexa och hybridglykoproteiner. I den mannosrika gruppen dominerar mannosrester. I den komplexa gruppen dominerar sackarider. Hybridgruppen är en hybrid. Kolhydratinnehållet i glykoproteiner är mellan några få procent för ribonukleaser och upp till 85 procent för blodgruppsantigener.
Funktion, effekt och uppgifter
Glykoproteiner uppfyller många funktioner i den mänskliga organismen. De är en strukturell komponent i cellmembranen och benämns också strukturella proteiner i detta sammanhang. De finns också i slem och används som smörjmedel i vätskor.
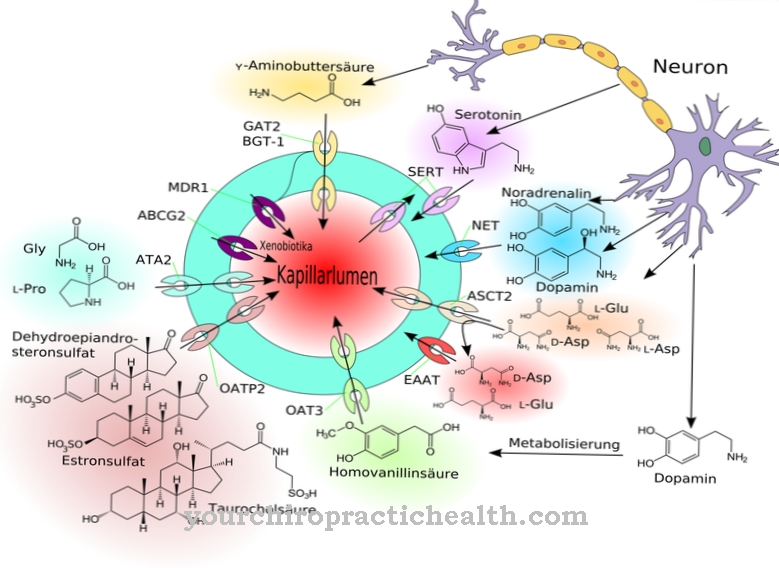
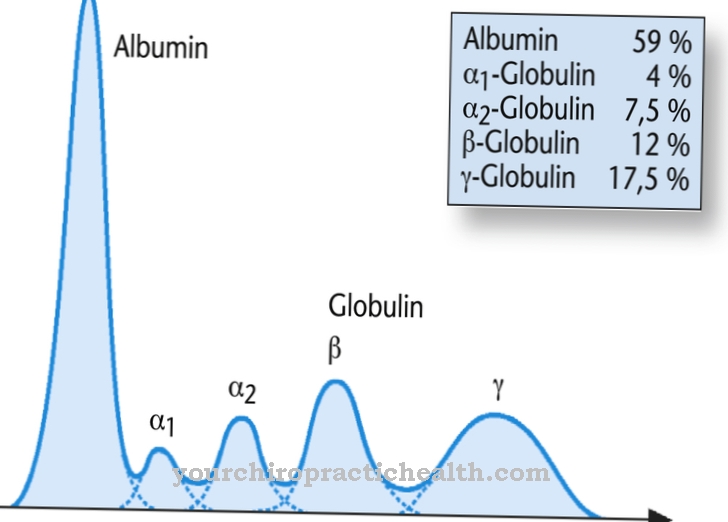
Som membranproteiner bidrar de till cellinteraktion. Vissa glykoproteiner har också hormonella funktioner, till exempel tillväxtfaktorn hCG. Ämnena är lika viktiga som immunologiska komponenter i form av immunoglobuliner och interferoner. Alla exportproteiner och membranproteiner i kroppen var fortfarande glykoproteiner, åtminstone under biosyntes. De är särskilt relevanta för igenkänningsreaktionerna i immunsystemet, eftersom de interagerar med immunologiska T-celler och T-cellreceptorer. Olika plasmaproteiner har isolerats i humant blodplasma, av vilka endast albumin och prealbumin inte har sockerrester.
Överflödet av glykoproteiner är fantastiskt. I slutändan innehåller nästan alla extracellulärt lösliga proteiner och enzymer sockerrester. Som hormoner har glykoproteiner en pleiotropisk effekt och är därför avgörande för aktiviteten hos olika organsystem. Hormonerna TSH, HCG och FSH är till exempel glykoproteiner. Som membranproteiner representeras de i rollen som receptorer såväl som transportörer och stabilisatorer. De har en stabiliserande effekt, särskilt tillsammans med glykolipider. Tillsammans med dessa ämnen bildar de den så kallade glykokalyxen, som stabiliserar celler utan en cellvägg.
Utbildning, förekomst, egenskaper och optimala värden
Den vanligaste bildningen av glykoproteiner är N-glykosidbindningen eller N-glykosylering till asparagin. Socker binder sig till de kvävefria syraamidgrupperna. N-glykosylering äger rum i endoplasmatisk retikulum. De sålunda bildade N-glykosiderna är den mest relevanta glykoproteingruppen.
Vid N-glykosylering snytetiserar sockerprekursorn på bärarmolekylen dolichol, oberoende av aminosyrasekvensen för målproteinet. OH-gruppen i slutet av molekylen är kopplad till difosfat. En oligosackaridprekursor bildas vid den slutliga fosfatresten av molekylerna. De första sju av sockerarna samlas på den cytosoliska sidan. Två N-acetyl-glukosaminer och fem manosrester är fästa till dolicholfosfat. Sockernukleotiderna BNP-mannos och UDP-N-acetyl-glukosamin framträder som givare. Prekursorn transporteras genom ER-membranet via ett transportprotein.
Prekursorn är således orienterad mot insidan av endoplasmatisk retikulum, där fyra mannosrester läggs till. Dessutom odlas glukosrester. Den 14 sockerlånga föregångaren överförs slutligen till ett protein. En annan formationsväg för glykoproteiner är O-glykosidbindningen eller O-glykosylering till serin, som äger rum i cellerna Golgi-apparaten. Sockret är bundet till en hydroxylgrupp i serinet. Glykoproteinvärden är särskilt relevanta i förhållande till plasmaproteiner eftersom de spelar en roll i ett komplett blodantal. Att lista alla normala värden för glykoproteiner individuellt vid denna punkt skulle överskrida omfattningen.
Sjukdomar och störningar
Vissa genetiska sjukdomar har effekter på glykosylering. En grupp av sådana sjukdomar är CDG. Glykoproteinerna visar onormala värden. De drabbade drabbas av långsam utveckling, som avser både fysiska och psykiska problem.
Squint kan vara ett annat symptom på den genetiska störningen. Totalt är cirka 250 olika gener involverade i bildandet av glokoproteiner. När det gäller medfödda glykosyleringsstörningar beror störningar i kopplingen av kolhydrat-sidokedjor till proteiner på en genetisk disposition. I den post-translationella modifieringen får proteiner sin fulla funktionalitet. I den här processen, när enzymerna eller proteinerna som bygger kolhydrat-sidokedjor sammanställs onormalt, skapas CDG. N-glykosylering påverkas oftast av störningar. Hittills har cirka 30 enzymdefekter upptäckts som påverkar N-glykosylering.
Genetiska O-glykosyleringsstörningar är något sällsynta. De manifesterar sig i neuromuskulära multisystemsjukdomar såsom Walker-Warburg syndrom. Eftersom glykoproteiner har så många funktioner i organismen kännetecknas den kliniska bilden av en mängd olika symtom. Alla organsystem kan påverkas av medfödda glykosyleringsstörningar. Psykomotoriska utvecklingsstörningar är huvudsymtomet. Neurologiska avvikelser är lika vanliga. Koagulationsstörningar eller endokrina störningar är inte heller ovanliga.

.jpg)

.jpg)