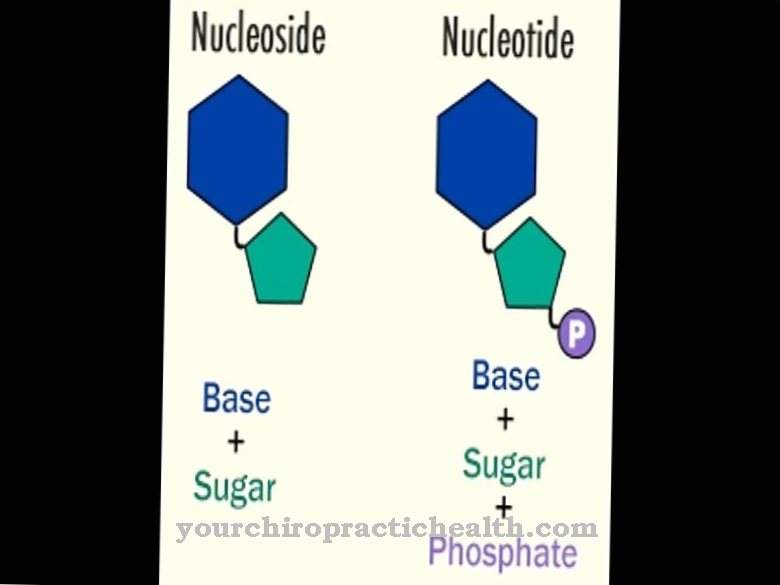
cytidin tillhör nukleosiderna och består av den nukleiska basen cytosin och sockerribosen. Det bildar ett baspar med guanosin via vätebindningar. Det spelar också en central roll i pyrimidinmetabolismen.
Vad är cytidin?
Cytidin är en nukleosid som består av cytosin och ribos. Förutom adenin, guanin och tymin är kvävebascytosin involverat i syntesen av nukleinsyror. Fosforylering av cytidin producerar cytidinmonofosfat (CMP), cytidindifosfat (CDP) eller cytidintrifosfat (CTP).
Cytidinmonofosfat är en nukleotid i RNA. Två purin- och två pyrimidinbaser är involverade i strukturen hos nukleinsyrorna, varvid tymin byts ut mot uracil i RNA. Adenin och guanin tillhör purinbaserna, medan tymin, cytosin och uracil tillhör pyrimidinbaserna. Cytidindeaminas kan deaminera cytidin till uridin. Uridin är en nukleosid tillverkad av ribos och uracil. Det kan också fosforyleras till uridinmonofosfat.
Uridinmonofosfat är också en viktig nukleotid för RNA. Vidare är CDP och CTP också aktiverande grupper för syntes av lecitin, cefalin och kardiolipin. Det rena cytidinet är närvarande som ett vattenlösligt fast ämne som sönderdelas vid 201 till 220 grader. Det kan nedbrytas katalytiskt till cytosin och ribos av enzymet pyrimidinnukleosidas.
Funktion, effekt och uppgifter
Cytidin spelar en central roll i pyrimidinmetabolismen. Pyrimidin tillhandahåller den grundläggande strukturen för pyrimidinbaserna cytosin, tymin och uracil som förekommer i nukleinsyror. Tymin i RNA byts mot uracil.
Uracil produceras också genom deaminering av cytidin med cytidindeaminas. De kemiska omvandlingarna mellan de tre pyrimidinbaserna är av central betydelse för reparationsprocesserna i DNA och de epigenetiska förändringarna. I samband med epigenetik modifieras olika egenskaper genom miljöpåverkan. Det genetiska materialet förändras dock inte. Modifieringsändringar av en organism orsakas av olika uttryck av gener. Differentieringsprocesser för kroppscellerna för bildning av olika cellinjer och organ representerar också en epigenetisk process Beroende på celltyp aktiveras eller inaktiveras olika gener.
Detta sker genom metylering av cytidinbaserna inom DNA. Under metylering bildas metylcytosin, som kan omvandlas till tymin genom deaminering. Den komplementära nukleobasguaninen i motsatt dubbelsträng gör det möjligt att känna igen felet och att tymin kan bytas ut mot cytosin igen. Guanin kan emellertid också bytas mot adenin, vilket leder till en punktmutation. Om det ommetylerade cytosinet deamineras, produceras uracil. Eftersom uracil inte förekommer i DNA, ersätts det omedelbart av cytosin. I stället för cytosin ökas mutationsgraden på grund av metylering något.
Samtidigt stängs emellertid fler och fler gener genom metylering, vilket resulterar i ytterligare specialisering av cellerna inom cellinjen. I reparationsprocesser baseras reparationsenzymerna på den ursprungliga DNA-strängen, som de känner igen genom en högre metyleringsgrad. Den komplementära strängen är också byggd på grundval av den information som lagras där. Installationsfel korrigeras omedelbart. Dessutom katalyserar enzymet AID (Activation Induced Cytidin Deaminase) mycket specifikt deamineringen av cytidingrupper till uridingrupper i enkelsträngat DNA. Somatiska hypermutationer förekommer, vilket förändrar antikroppssekvenserna för B-celler. Sedan väljs de matchande B-cellerna. Detta möjliggör ett flexibelt immunsvar.
Utbildning, förekomst, egenskaper och optimala värden
Cytidin är en mellanprodukt av pyrimidinmetabolismen. Som en isolerad anslutning spelar det ingen roll. Som redan nämnts består den av nukleisk bascytosin och kvintupelsockerribosen. Kroppen kan syntetisera cytosin själv.
Emellertid är syntesen mycket energikrävande, så att den utvinns från byggstenar för nukleinsyror inom räddningsvägen och kan återintegreras till nukleinsyror. När basen bryts helt fram produceras koldioxid, vatten och urea. Den är närvarande som en nukleosid i RNA. I DNA är cytosin bundet till deoxiribos, så att nukleosiddeoxicytidinen förekommer här som en byggsten.
Sjukdomar och störningar
Metyleringarna på cytidinresterna av DNA är mycket viktiga för markeringar för att separera olika biokemiska processer. Men det kan också förekomma fel i metylering som leder till sjukdom.
Vid defekta metyleringar kan både ökad och minskad genaktivitet utlösas som inte uppfyller kraven. Dessa metyleringsmönster överförs under celldelning. På lång sikt inträffar förändringar som kan leda till sjukdomar. Till exempel har vissa tumörceller olika metyleringstrukturer som inte förekommer i friska celler. Till exempel kan metylering blockera vissa gener som kodar för tillväxtreglerande enzymer. Om dessa enzymer saknas kan oinhiberad celltillväxt förekomma. Detta gäller även enzymer som initierar ordnad celldöd (apoptos) när celldefekter uppstår.
En målinriktad påverkan av DNA-metylering är ännu inte möjlig idag. Det finns emellertid studier på fullständig demetylering av tumörceller för att återigen utsätta dem för kontrollen av de tillväxtreglerande proteinerna. Enligt flera kliniska studier har demetylering visat sig begränsa tumörtillväxt hos patienter med akut myelooid leukemi. Denna procedur är också känd som epigenetisk terapi. Metyleringsprocesser kan också spela en roll vid andra sjukdomar. På grund av miljöpåverkan anpassar organismen sig till förändrade förhållanden med bildandet av biologiska modifieringar baserade på metylering av DNA-cytidinresterna. Kroppen genomför således en inlärningsprocess, som emellertid också kan orsaka felaktig reglering.







.jpg)